O que é pH?
Por Fidel Forato | Editado por Luciana Zaramela | 27 de Setembro de 2022 às 09h00
Na química, é comum usar a escala numérica do pH para medir o nível de acidez, neutralidade ou alcalinidade de uma solução aquosa (com água). Com variação entre 0 e 14, cada número na escala é determinado a partir da concentração de íons de hidrogênio (H+ ou H3O+). Quanto mais íons, mais ácida será a amostra e esse número deve ser aproximar de 0. Enquanto isso, o 14 indica uma solução básica (alcalina), com menos íons.
Embora o conceito do pH possa parecer um tanto quanto abstrato, ele está mais presente no nosso dia a dia do que se imagina. Muito provavelmente, você já sentiu "acidez" no estômago. Isso porque o pH da região deveria estar desequilibrado, ou seja, muito ácido (mais perto do 0 que do 14).
Dependendo do nível de acidez, é possível melhorar após beber um copo de leite (básico), já que isso ajuda a neutralizar o pH do seu organismo.
Entenda o que é pH
Na química, a sigla pH se refere a uma função (p) que calcula o potencial da espécie a ser analisada (H). Em outras palavras, pH significa potencial hidrogeniônico. O pH expressa a quantidade de íons H+ ou H3O+ em uma solução.
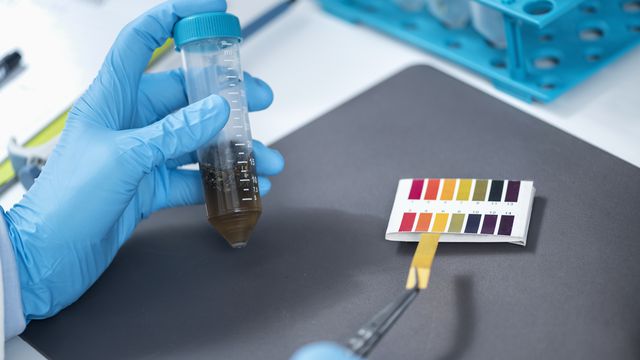
Além dos números do pH, os químicos também podem relacionar a acidez de uma solução através de cores, o que é feito em experimentos com indicadores ácido-base, de origem natural ou sintética.
São "fitinhas" que, ao entrarem em contato com a solução, mudam de cor, indicando se uma mistura é alcalina, ácida ou neutra. Entre os indicadores mais comuns para os testes, estão o papel de tornassol e o indicador universal.
A seguir, entenda como é a classificação para cada cenário:
- Ácido: pH deve ser menor que 7, podendo chegar até o 0. Em testes com os indicadores ácido-base, tende a apresentar cores mais próximas do vermelho;
- Neutro: pH é 7 e, em experimento, as fitinhas ficam na cor verde;
- Básico/Alcalino: pH é maior que 7, mas deve ser menor que 14. A coloração fica mais próxima do azul e do roxo.
Afinal, pH é importante?
Além do metabolismo, é importante explicar que o pH é uma medida de extrema importância para o meio-ambiente e tem diferentes aplicabilidades práticas. Por exemplo, na agricultura a escala é usada para o melhor desenvolvimento de plantas — se você se interessa por vinhos, vale lembrar que solos com pH mais ácidos resultam numa uva diferente daquela cultivada em regiões com terra mais alcalina.
O estudo do pH também é fundamental para empresas que tratam o esgoto, já que o descontrole pode provocar a morte de peixes. Em ambientes com pH muito baixo (menor que 5), o que pode acontecer com o despejo de materiais ácidos, os peixes podem morrer imediatamente, segundo a Companhia Ambiental do Estado de São Paulo (Cetesb).
Com descarte inadequado de amônia — o pH pode chegar a 9 ou mais — e altas temperaturas, o meio pode se tornar extremamente tóxico para os animais, também provocando mortes. Situações semelhantes podem ser enfrentadas por quem tem aquário em casa.
Quem inventou o pH?
Em 1909, o químico dinamarquês Søren Peter Lauritz Sørensen introduziu, pela primeira vez, o conceito de pH na química. No entanto, a escala não se tornou rapidamente popular entre os químicos e chegou a ter sua lógica questionada por não ser tão intuitiva. Por exemplo, soluções ácidas têm mais íons que as básicas, só que recebem um número menor na escala.
"A escala de pH, apesar de cômoda e hoje usual, não foi aceita de imediato entre os químicos, sofrendo duras críticas. O primeiro livro de Química que menciona o conceito de pH foi publicado em 1914, cinco anos após a proposição de Sörensen", explicam os pesquisadores Michelle da Silva Gama e Júlio Carlos Afonso, da Universidade Federal do Rio de Janeiro (UFRJ), em artigo para a revista científica Química Nova. No Brasil, os primeiros livros começaram a abordar a questão em 1920.
Fonte: Química Nova, Mundo Educação e Cetesb