Anvisa aprova documentos de novo pedido para uso emergencial da Coronavac
Por Felipe Demartini | 20 de Janeiro de 2021 às 11h05
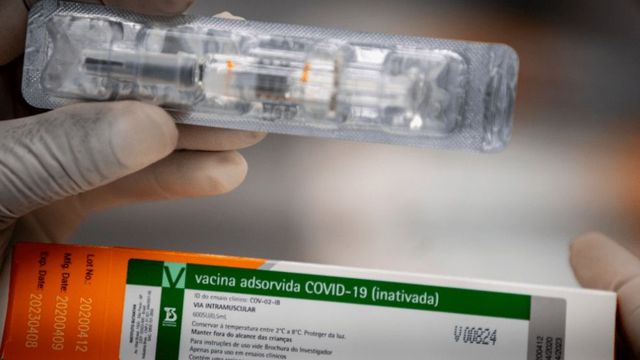
[UPDATE 23/01, às 18h25]: Por unanimidade, os gestores da Anvisa aprovaram a solicitação do Butantan para uso emergencial das novas doses. Agora, é necessário incluí-las na campanha de imunização nacional, dividindo-as pelos estados. Após o pedido de uso emergencial feito pelo instituto, a estimativa de 4,8 milhões de doses foi corrigida: após o processo de envase e checagem do lote, 4,1 milhões de doses estão prontas para distribuição, das quais 900 mil já foram liberadas na última sexta-feira (23).
| Leia, abaixo, a notícia na íntegra, publicada pelo Canaltech em 20/01 |
A Agência Nacional de Vigilância Sanitária (Anvisa) aprovou a nova entrega de documentos relacionados ao segundo pedido de uso emergencial da Coronavac. A solicitação da vez está relacionada a 4,8 milhões de doses que foram importadas da China e envasadas pelo Instituto Butantan, de São Paulo (SP).
- COVID-19 | Vacinação começou nesta segunda em todo o país
- Novo cronograma de vacinação em SP ainda não tem data prevista para idosos
- Quando a Fiocruz vai começar a produção da vacina contra COVID-19?
Em análise preliminar, a Anvisa afirma que os documentos encaminhados pelo centro são satisfatórios para a nova análise, que deve se concentrar nas diferenças entre os procedimentos de produção e envase em relação às doses importadas diretamente e que já estão sendo aplicadas em profissionais da saúde de todo o Brasil. A ideia é entender se podem existir diferenças que impactam a qualidade do produto final pelo uso de equipamentos e métodos diferentes, assim como analisar os processos de transporte dos medicamentos.
Os imunizantes somente poderão ser aplicados após o aval da agência, com a expectativa de resposta sobre esse segundo lote sendo emitida até sexta-feira (22). A expectativa é de liberação, principalmente após a aprovação de uso emergencial das vacinas, concedida no último domingo (17).
De acordo com a Anvisa, a nova análise não é tão extensa, já que muito do trabalho foi feito na última semana para a liberação inicial, com o foco, agora, recaindo sobre as variações entre os trabalhos nacionais e internacionais. A agência, por meio de seu gerente-geral de medicamentos, Gustavo Mendes, afirmou estar trabalhando rápido para garantir celeridade nas avaliações.
Processo
O processo seguiu da mesma maneira que o original, começando por uma triagem dos documentos que, concluída agora, certificou que todos os registros necessários para a avaliação foram entregues pelo Instituto Butantan. São mais de 930 páginas que serão analisadas pelas áreas técnicas da Anvisa, com o intuito de aprovar as condições técnicas e operacionais da fabricação da Coronavac por aqui.
Sendo assim, caso disponibilize novas doses utilizando os mesmos parâmetros, novas aprovações de uso emergencial não serão exigidas. Por outro lado, caso existam mudanças nos insumos, equipamentos e qualquer tipo de procedimento, uma nova solicitação de aprovação deve ser feita junto à agência de vigilância sanitária.
A possível rapidez na aprovação também afasta, pelo menos por enquanto, os temores de uma interrupção na vacinação por conta da falta de doses do imunizante. A primeira leva de vacinação, em andamento desde segunda (18) conta com 4,63 milhões de unidades, que foram distribuídas entre estados e, depois, municípios para aplicação como parte do Plano de Imunização Nacional. Nesta primeira etapa, recebem a vacina os trabalhadores da saúde, população indígena, pessoas com necessidades especiais e idosos internados.
Além das unidades do Instituto Butantan, a Anvisa concedeu aprovação, também, ao imunizante produzido pela AstraZeneca e conhecido como vacina de Oxford, pela parceria com a universidade de mesmo nome. Entretanto, para que a aplicação comece, o Brasil aguarda a concessão de 2 milhões de doses pela Índia. Há atrito entre o Ministério das Relações Exteriores, enquanto o governo estrangeiro inicia sua vacinação local e concede unidades a nações vizinhas, como parte do plano de controle da Covid-19 na região. Não há previsão de liberação para o nosso país.