O que é um átomo?
Por Daniele Cavalcante | Editado por Patricia Gnipper | 09 de Outubro de 2022 às 19h00
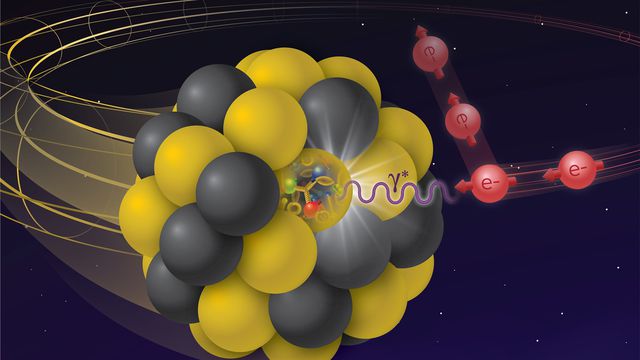
Os átomos são partículas minúsculas que formam as moléculas de toda a matéria visível. Tudo o que nos cerca é feito de átomos ligados entre si — a molécula da água, por exemplo, é feita de dois átomos de hidrogênio e um de oxigênio.
Mas exatamente o que é átomo?
Você se lembra da tabela periódica? Ali, estão listados todos os tipos de átomos conhecidos pela ciência, inclusive alguns criados em laboratório (não existem na natureza). A estrutura básica dos átomos é sempre a mesma: são formados por prótons, nêutrons e elétrons.
Prótons e nêutrons
Prótons e os nêutrons são partículas não fundamentais (formados por partículas ainda menores chamadas quarks) que, juntas, formam o núcleo do átomo. Ao redor desse núcleo, estão os elétrons, distribuídos em até 7 camadas.
Prótons e elétrons têm cargas elétricas iguais e opostas — os primeiros têm carga positiva e os últimos têm carga negativa. Já os nêutrons, como o próprio nome sugere, não possui carga elétrica. Normalmente, os átomos têm números iguais de prótons e elétrons, resultando em uma carga neutra.
Elétrons
Os elétrons são partículas fundamentais (não são formados por nada menor que eles) que orbitam os núcleos atômicos em camadas. Eles têm carga elétrica negativa e são as partículas que “criam” a eletricidade.
Para conduzir energia elétrica, são necessários materiais condutores, como muitos tipos de metais. Eles possuem uma grande quantidade de elétrons fracamente ligados aos núcleos atômicos, transmitindo a eletricidade com maior facilidade.
Quanto mais elétrons, mais camadas (também chamadas de níveis de energia) são necessárias, já que cada uma delas tem um limite de quantidade de elétrons para comportar. São eles:
- 1ª camada: até 2 elétrons
- 2ª camada: até 8 elétrons
- 3ª camada: até 18 elétrons
- 4ª camada: até 32 elétrons
- 5ª camada: até 32 elétrons
- 6ª camada: até 18 elétrons
- 7ª camada: até 2 (alguns autores consideram até 8)
Núcleo atômico
Os núcleos atômicos também variam em quantidade de prótons e nêutrons. Eles podem ser instáveis, normalmente quando apresentam um número de prótons maior ou igual a 84 (existem algumas exceções, como o Césio-137, com 55 prótons).
Quando o átomo de um determinado elemento é instável, seu núcleo “se parte” facilmente, liberando radiações eletromagnéticas e desintegrando-se. Por isso, isótopos como o Césio-137 e o Urânio-235 são altamente radioativos.
Para descobrir a quantidade de prótons em átomos de um elemento, basta conferir o número atômico na tabela periódica. Este número representa a quantidade de prótons e, como os átomos em seu estado “normal” são eletricamente neutros, o número de prótons é igual ao número de elétrons.
Com a tabela periódica, também podemos obter o número de nêutrons: basta subtrair a quantidade de prótons do número de massa atômica (também disponível na tabela, logo abaixo do nome de cada elemento). No caso do Césio, o número de nêutrons é: número atômico (55) + número de massa (132,91) = 78.
Também é preciso ficar atento às variações dos elementos, já que isótopos têm diferentes quantidades de nêutrons. Por exemplo, o isótopo Césio-137: o número "137” descreve a soma de prótons e nêutrons (55 + 82 = 137).